Paris, France — Dans le traitement percutanée des fuites mitrales sévères, la mise en place par voie transeptale de l’Altavalve (4C Medical), une valve fixée par le déploiement d’une cage qui vient couvrir tout l’intérieur de l’oreillette, est associé à des bénéfices cliniques qui se maintiennent à six mois, selon les résultats d’une étude de faisabilité présentés lors du congrès EuroPCR2024[1].
« La fixation atriale permet de traiter un large éventail d’anatomie de la valve mitrale », a commenté l’auteur principal, le Dr Vlasis Ninios (Interbalkan European Medical Center, Thessalonique, Grèce), lors de sa présentation. Seule limite avec le dispositif actuellement à l’essai: le diamètre de l’oreillette ne doit pas dépasser 9 cm pour pouvoir contenir la cage, a précisé le cardiologue.
Le dispositif a l’avantage de pouvoir bénéficier aux patients présentant des calcifications sur les feuillets de la valve mitrale. « Des patients inéligibles au TEER [réparation transcathéter bord à bord de type Mitraclip, ndr] et pour lesquels il n’y a pas vraiment d’option », a rappelé le Dr Sebastian Ludwig (University Heart & Vascular Center Hamburg, Hambourg, Allemagne), lors d’un échange en fin de présentation.
Lancement d’une étude pilote
AltaValve a reçu le statut de dispositif d’exception (label « Breakthrough ») de la part de la Food and Drug Administration (FDA). Une étude pilote sera lancée cet été, a annoncé le Dr Ninios. Elle devrait inclure 450 patients avec insuffisance mitrale modérée à sévère ayant des contre-indications au traitement chirugical ou à la réparation transcathéter bord à bord. Parmi eux, 150 devront présenter des calcifications sur valve mitrale.
Le remplacement de la valve mitrale par voie percutanée (TMVR) avec une bioprothèse spécifique est une option thérapeutique émergente dans le traitement des patients souffrant d’une insuffisance mitrale. Cette approche est toutefois complexe en raison de l’anatomie de la valve mitrale et le traitement chirurgical reste privilégié en cas d’insuffisance sévère.
Alors que l’anneau de la valve aortique est rigide, rond et plat, ce qui permet de poser aisément une prothèse en percutané (TAVI), celui de la valve mitrale est souple et irrégulier, a indiqué le cardiologue. « Compte tenu de la dynamique de la valve mitrale et de sa forme irrégulière, le choix de la taille et du mode de fixation [de la prothèse à insérer] représente un défi. »
Différents modèles de prothèses de remplacement de la valve mitrale ont été mis au point avec des systèmes d’ancrage complexes, mais sans réel succès. L’approche mini-invasive consistant à poser la prothèse en passant par la zone apicale du coeur (système Tendyne) est la seule option validée, avec cependant un risque d’obstruction du ventricule gauche.
Plus de 70% des patients éligibles
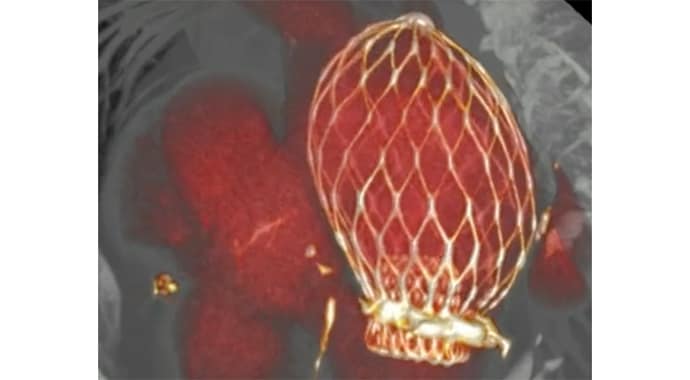
L’originalité de la bioprothèse Altavalve réside dans son absence de mécanisme d’attachement. Son maintien au dessus de la valve mitrale est assuré par le déploiement d’une cage constituée de 24 cellules en nitinol (alliage flexible de nickel et de titane) qui viennent épouser toute la surface interne de l’oreillette gauche. Le dispositif est inséré par voie transeptale et sa position peut être ajustée après déploiement.
La bioprothèse a l’avantage de réduire le risque d’obstruction du ventricule gauche et de préserver la valve native, rappelle le cardiologue. « Ce dispositif a étendu à plus de 70% le taux d’éligibilité [au remplacement de la valve mitrale] des patients avec insuffisance mitrale sévère. » Une oreillette trop large (diamètre > 9 cm) est la cause majeure d’exclusion.
Menée aux Etats-Unis et en Europe, l’étude prospective multicentrique a inclus 17 patients à haut risque chirurgical (77 ans en moyenne) présentant une insuffisance mitrale symptomatique sévère (NYHA III/IV dans 80% des cas), avec fraction d’éjection du ventricule gauche préservée (FEVG moyen de 54%).
Six mois après l’implantation, les fuites mitrales restaient absentes dans 81% des cas. La régurgitation est apparue légère dans les autres cas. Le taux de NYHA de stade III est passé de 73% à 6%. A six mois, les trois quart des patients présentaient peu de symptômes (NYHA de stade II).
Performances hémodynamiques préservées
La mortalité toutes causes est de 10% à un mois et 13% à six mois. La mortalité d’origine cardiaque est de 7% à un et six mois. Aucun AVC n’a été rapporté. Il n’y a pas eu non d’hémorragie sévère lors de la pose du dispositif.
Concernant la fraction d’éjection, elle est restée préservée (FEVG moyenne de 50% à six mois) « certainement en raison des faibles interactions avec le ventricule gauche ».
La qualité de vie s’est retrouvée nettement améliorée, avec une hausse moyenne du score KCCQ de 13 points à six mois. Le test de marche des six minutes (6MWT) montre une progression, qui s’est traduite par une distance parcourue en six minutes augmentée de 50 mètres.
« Les résultats apportent la preuve de la sécurité et de l’efficacité durable de la bioprothèse avec une préservation des performances hémodynamiques », a conclu le Dr Ninios.
