Allemagne – Selon une nouvelle étude menée en Allemagne, la majorité des femmes atteintes de malformations cardiaques congénitales peuvent envisager une grossesse en toute sécurité et donner naissance à des bébés en bonne santé.
En analysant les données administratives de 7512 grossesses chez 4015 femmes atteintes de cardiopathie congénitale, les chercheurs ont constaté que les taux de complications maternelles et néonatales étaient plus élevés que dans un groupe témoin apparié : selon le rapport publié dans l’European Heart Journal , le risque de mortinatalité ou de décès néonatal était légèrement plus élevé chez les femmes atteintes de cardiopathie congénitale, et le taux de récurrence de la cardiopathie congénitale chez les nourrissons était six fois plus élevé. Cependant, les taux absolus restaient faibles, et il n’y avait pas de décès maternel à déplorer.
« Cette étude est un message d’espoir », affirme la première auteure, le Dr Astrid Lammers, consultante en cardiologie pédiatrique à l’hôpital universitaire de Münster. « Il y a seulement 50 ans, 85 % des enfants nés avec une cardiopathie congénitale mouraient avant d’atteindre l’âge adulte. Aujourd’hui, bien plus de 90 % d’entre eux survivent jusqu’à cet âge, et ils sont nombreux à atteindre la vieillesse. »
Les résultats de l’étude montrent que « les femmes traitées pour une cardiopathie congénitale – sans doute l’une des formes les plus graves de cardiopathie – peuvent mener une grossesse à terme et fonder leur propre famille », ajoute Astrid Lammers. « Ces observations rassurantes témoignent des progrès de la cardiologie congénitale et de la chirurgie cardiaque, qui permettent à la plupart des femmes porteuses d’une malformation cardiaque congénitale de survivre et de mener une vie relativement normale. »
Astrid Lammers conseille cependant aux femmes concernées de consulter un spécialiste avant d’entamer une grossesse. « Il est important que les femmes porteuses d’une cardiopathie congénitale soient suivies dans une clinique spécialisée, et qu’elles reçoivent des conseils et des soins appropriés avant et pendant la grossesse. Aujourd’hui, dans les pays développés, la majorité de ces femmes peuvent mener à bien leur grossesse en toute sécurité. Si le taux de mortalité est très faible, les complications chez ces futures mères sont, en revanche, relativement fréquentes, et elles le sont plus particulièrement chez leurs nouveau-nés. Mais la plupart des problèmes touchant ces bébés peuvent être surmontés grâce à des soins médicaux et un soutien néonatal. »
Pour étudier de plus près les grossesses chez les femmes atteintes de cardiopathie congénitale, Astrid Lammers et son équipe se sont tournés vers les données administratives de la compagnie d’assurance-maladie BARMERGEK, qui assure environ 1 personne sur 9 en Allemagne et dont les cotisants sont représentatifs de la population générale.
Au total, 25585 femmes atteintes de cardiopathie congénitale adulte et âgées entre 10 et 55 ans étaient incluses dans la base de données. Parmi elles, 4015 ont eu au moins une grossesse entre 2005 et 2018. Les chercheurs ont identifié par ailleurs une cohorte appariée selon l’âge de 50 813 femmes sans cardiopathie congénitale, cohorte qui a servi de groupe témoin. Parmi elles, 6502 femmes ont connu au moins une grossesse pendant la période étudiée.
Les accouchements par césarienne étaient plus fréquents chez les patientes atteintes de cardiopathie congénitale que dans le groupe témoin (40,5 versus 31,5 %). Il n’y a pas eu de surmortalité et les taux de complications maternelles, faibles en termes absolus, étaient pour la plupart similaires à ceux du groupe témoin. Les femmes atteintes de cardiopathie congénitale présentaient toutefois un taux statistiquement significatif d’AVC (1,03 versus 0,17 %), surtout celles qui présentaient des malformations cardiaques de complexité modérée (9,8 fois plus élevées que les témoins) ou élevée (6,6 fois plus élevées).
La mortalité néonatale était faible dans l’absolu mais toujours significativement plus élevée dans le groupe cardiopathie congénitale (0,83 versus 0,22 %). En outre, les nouveau-nés dont la mère était atteinte de cardiopathie congénitale étaient plus susceptibles d’avoir un poids de naissance insuffisant (7,54 versus 5,25 %) ou très faible (1,01 versus 0,53 %), et de nécessiter une ventilation mécanique (8,74 versus 3,57 %).
Les enfants de femmes atteintes de cardiopathie congénitale étaient également plus susceptibles d’être atteints du syndrome de Down (0,91 versus 0,21 %), de présenter d’autres syndromes génétiques (1,16 versus 0,31 %), d’avoir un code de cardiopathie congénitale enregistré (17,7 versus 2,9 %) et de devoir subir une intervention chirurgicale cardiaque avec assistance par machine cœur-poumon avant l’âge de 6 ans (5,95 versus 0,39 %).
Les prédicteurs significatifs d’une issue néonatale défavorable comprenaient la complexité de l’anomalie maternelle, l’hypertension artérielle, l’insuffisance cardiaque, un traitement antérieur de l’infertilité et l’anticoagulation par un antagoniste de la vitamine K.
« L’élément le plus important à retenir de cette étude est qu’il ne devrait pas y avoir autant d’hésitation à ce que les femmes atteintes de cardiopathie congénitale entament une grossesse », commente le Dr Ari Ceders, professeur associé de médecine et de pédiatrie à l’hôpital Johns Hopkins de Baltimore. « L’article s’ajoute aux données croissantes qui suggèrent que ces femmes peuvent vivre une vie normale. Néanmoins, il existe un petit groupe de femmes atteintes de cardiopathie congénitale qui seraient plus à risque. Il s’agit des femmes souffrant d’aortopathie grave, d’hypertension pulmonaire, de cardiopathie valvulaire gauche sévère ou de dysfonctionnement important du ventricule gauche »
Pour sa part, le Dr Arvind Hoskoppal, qui dirige le programme de cardiopathie congénitale pour adultes à l’UPMC de Pittsburgh insiste sur la nécessité de suivre ces femmes dans des centres spécialisés. « Elles devraient recevoir des conseils dès avant la conception. La stratification des risques et la prise en charge médicale sont importantes. Néanmoins, il n’y a que de rares cas où nous déconseillons la grossesse à cause d’un risque de mortalité maternelle ».

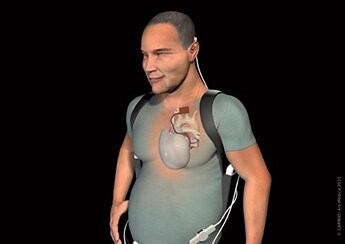 Le cœur artificiel total de CARMAT est composé d’une bioprothèse implantable et d’un système portable d’alimentation externe auquel elle est reliée en permanence. Il a été inventé par le Pr Alain Carpentier pour pallier le manque de greffons pour les personnes souffrant d’insuffisance cardiaque terminale irréversible. La première implantation chez l’homme a été réalisée en 2013 à l’hôpital européen Georges-Pompidou. En 2016, la startup française a cependant dû stopper son essai clinique après la mort d’un cinquième patient. Aussi, en 2018, la société a suspendu son essai en Europe en raison des risques de dysfonctionnement des prothèses. Après des modifications, le cœur artificiel a obtenu le « marquage CE » pour l’indication d’attente de transplantation, fin décembre 2020. En parallèle, l’ANSM a autorisé Carmat à reprendre les implantations en France en octobre dernier. Une nouvelle étude clinique chez 52 patients greffés a débuté.
Le cœur artificiel total de CARMAT est composé d’une bioprothèse implantable et d’un système portable d’alimentation externe auquel elle est reliée en permanence. Il a été inventé par le Pr Alain Carpentier pour pallier le manque de greffons pour les personnes souffrant d’insuffisance cardiaque terminale irréversible. La première implantation chez l’homme a été réalisée en 2013 à l’hôpital européen Georges-Pompidou. En 2016, la startup française a cependant dû stopper son essai clinique après la mort d’un cinquième patient. Aussi, en 2018, la société a suspendu son essai en Europe en raison des risques de dysfonctionnement des prothèses. Après des modifications, le cœur artificiel a obtenu le « marquage CE » pour l’indication d’attente de transplantation, fin décembre 2020. En parallèle, l’ANSM a autorisé Carmat à reprendre les implantations en France en octobre dernier. Une nouvelle étude clinique chez 52 patients greffés a débuté.