Medtronic procède au rappel d’un seul lot de batteries du système HeartWare™ Ventricular Assist Device (HVAD™) (429 batteries au total).
Voir le courrier de Medtronic ci dessous:
Informations sur les maladies cardiaques, stimulateurs cardiaques (pacemaker), défibrillateurs, greffe cardiaque, insuffisance cardiaque
Medtronic procède au rappel d’un seul lot de batteries du système HeartWare™ Ventricular Assist Device (HVAD™) (429 batteries au total).
Voir le courrier de Medtronic ci dessous:
Je vais parler aujourd’hui de restriction à la conduite automobile et pathologies cardiovasculaires, car un arrêté vient d’être publié au Journal officiel. Mais tout d’abord, passons en revue des publications récentes à ce sujet.
Si on recherche les articles récents qui traitent des restrictions automobiles, on retrouvera un article de 2020 qui récapitule ces restrictions. Les auteurs se sont intéressés au côté rythmologique des restrictions automobiles dans les pays européens et on voit que ces restrictions sont différentes d’un pays à l’autre. Par exemple, lorsqu’on s’adresse à la conduite automobile à titre privé, on voit que :
Bien entendu, la conduite à titre professionnel est contre-indiquée, donc pour les conducteurs de camion, de bus ou de taxi etc.
Mais ces chiffres sont différents d’un pays à l’autre – en Autriche par exemple, après un défibrillateur il faut attendre 6 mois, et en France 3 mois comme dans le texte européen.
Si on regarde les publications récentes, on retrouve un registre qui s’est intéressé aux patients porteurs de défibrillateurs et qui a été publié dans le European Heart Journal en 2021. Les auteurs ont retrouvé que chez les sujets implantés d’un défibrillateur entre 2013 et 2016, 94 % avaient repris la conduite automobile, un tiers n’avait pas respecté les restrictions de durée et 35 % reprenaient une conduite automobile à titre professionnel. La bonne nouvelle est que sur ces 3 900 patients, il y en avait à peine 5, soit 0,2 %, qui avaient eu un choc lors de la conduite automobile – c’est-à-dire que l’estimation de ce risque était 0,000 2 % par personne/année, soit très faible.
Récemment dans la revue Circulation, l’étude DREAM-ICD-II a été publiée. C’est un registre canadien réalisé à partir de 3 centres spécialisés au Canada entre 2016 et 2020. Les auteurs avaient, sur une période de suivi de 760 jours, 720 patients implantés qui étaient en prévention secondaire, et ils retrouvaient un taux d’incidence des chocs qui était significatif au cours des trois premiers mois, puis se réduisait de manière importante. Et l’incidence d’une syncope de cause rythmique était de 1,8 % au cours des 90 premiers jours, puis 0,4 % entre 3 mois et 180 jours – c’est-à-dire que cela plaidait en faveur d’une restriction automobile pendant les trois premiers mois.
Un arrêté vient d’être publié le 28 mars 2022 concernant les affections médicales compatibles ou incompatibles avec la conduite automobile, que celle-ci soit personnelle ou professionnelle. Le document est accessible gratuitement en ligne et vous allez pouvoir retrouver toutes les pathologies cardiovasculaires, avec bien entendu les pathologies rythmiques – c’est mon domaine –, les pathologies cardiaques, mais également les pathologies extracardiaques.
J’ai trouvé intéressant le fait qu’il y a un certain nombre d’éléments que nous n’appliquons pas en pratique. Par exemple :
Bien sûr, ces recommandations traitent également de la conduite à titre professionnel, et vous retrouvez toute la liste des pathologies qui la contre-indiquent. Là aussi, j’ai trouvé intéressant de rappeler qu’un patient insuffisant cardiaque qui a une fraction d’éjection inférieure à 35 % est contre-indiqué à la conduite automobile à titre professionnel dès la classe I de la NYHA.
Bordeaux, France — Au CHU de Bordeaux, deux patients, dont un garçon de onze ans, ont été opérés début avril de malformations cardiaques (communication interauriculaire), grâce à une prothèse biodégradable (ReSept ASD Occluder, atHeart Medical). Une première en France, racontée par le Pr Jean-Benoît Thambo, chef du service des Maladies cardiaques congénitales du Fœtus, de l’Enfant et de l’Adulte au CHU de Bordeaux.
« Nous avons réalisé une intervention de cardiologie interventionnelle sur deux patients souffrant de malformations conduisant à une communication inter-auriculaire. C’est une pathologie très fréquente, qui peut entraîner une dilatation du cœur, causer un essoufflement, des irrégularités du rythme cardiaque, une fatigabilité et parfois des difficultés à accomplir des efforts importants », détaille le Pr Jean-Benoît Thambo.
Pour réaliser l’intervention, les cardiologues interventionnels sont passés par la veine fémorale, sans ouvrir le thorax. « Nous sommes venus mettre une prothèse en forme d’ombrelle pour fermer le trou entre les deux oreillettes du cœur », ajoute-t-il (voir la vidéo explicative ici).
Originalité de l’intervention : la prothèse utilisée est en partie biodégradable. « D’habitude, l’intervention consiste à mettre un dispositif constitué d’un alliage métallique de nickel et de titane. Le métal reste dans le cœur mais il est tapissé quasiment complètement par les cellules du patient. Cette fois, l’idée est que le matériel de la prothèse soit complètement digéré par les tissus du patient. Quand la prothèse est complètement dégradée, on ne retrouve plus du tout de corps étranger à l’intérieur du patient », explique-t-il. La prothèse est constituée d’un polymère biocompatible qui a la capacité de se dégrader. Elle comprend aussi deux patchs de tissu non biodégradable, en polyester, qui seront colonisés par les cellules du patient et assureront la fermeture du trou, pour garantir qu’il n’y ait plus de communication entre les deux oreillettes.
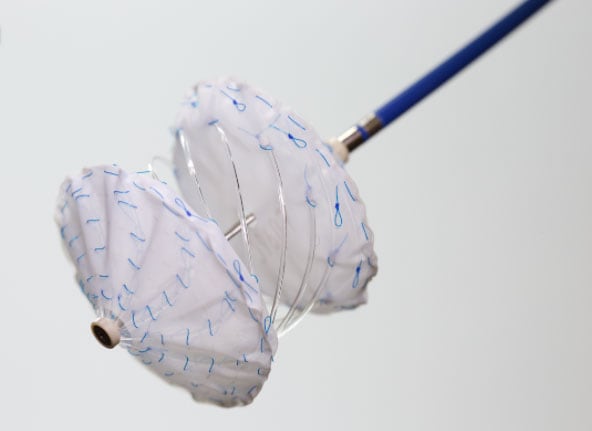
Deux patients, Léo, onze ans et un jeune adulte, ont d’ores et déjà été opérés avec cette prothèse. Le Pr Thambo n’y voit que des avantages. « Théoriquement, en supprimant tout corps considéré comme étranger par l’organisme, on évite les phénomènes d’allergies, de réactions inflammatoires chroniques et probablement d’infections. C’est le Graal que nous essayons de poursuivre ! » s’enthousiasme-t-il. Pour lui, l’utilisation de ce type de prothèse est « la première étape de la médecine de demain, qui permettra de traiter les pathologies que l’on prend en charge aujourd’hui avec des prothèses entièrement biologiques pouvant résister aux conséquences des mécanismes inflammatoires chroniques et ultimement de grandir avec le patient ».
Medtronic vous informe que nous investiguons un nouveau problème concernant le système HeartWare™ Ventricular Assist Device (HVAD™). Medtronic a reçu trois (3) signalements de patients soupçonnant une thrombose de la pompe ; cependant, un mauvais fonctionnement du dispositif a été identifié lors de l’inspection des trois (3) pompes retournées. Des marques d’usure indiquaient que le rotor tournait de manière non concentrique et entrait en contact avec le montant central de la pompe (voir la figure 1 Illustration de la pompe). L’enquête en cours suggère que cela a été causé par un défaut de soudure qui a permis à l’humidité de pénétrer dans le montant central et de corroder les aimants qui maintiennent la rotation concentrique du rotor.
Ces trois pompes ont été fabriquées entre décembre 2017 et mai 2018. Un échange de pompe a été effectué pour les trois patients. Le délai entre la présentation initiale et le changement de pompe était de cinq jours pour deux (2) patients et de cinq mois pour un (1) patient. Un (1) patient a ensuite été transplanté deux mois après l’échange de la pompe et est décédé un mois plus tard ; un (1) autre patient est décédé trois semaines après l’échange du DAV.
Une investigation est en cours pour identifier les pompes HVAD qui pourraient être concernées. Pour l’instant, Medtronic communique la possibilité de ce mode de défaillance à tous les professionnels de santé qui implantent et gèrent les HVAD, et diffusera une autre communication détaillée dès que des informations supplémentaires seront disponibles.
Par cette lettre, nous souhaitons vous alerter sur le fait que les patients porteurs des dispositifs concernés peuvent présenter des signes et des symptômes qui ressemblent à une thrombose de la pompe.
Les trois patients présentaient un ou plusieurs des signes et symptômes suivants :
• Bruits anormaux de la pompe tels que : friction ou vibration excessive ;
• Pics de puissance transitoires sur les fichiers journaux et alarmes de haute consommation en Watts ;
• Taux élevé de lactate déshydrogénase (LDH) ;
• Faible vitesse du moteur entraînant une faible perfusion ;
• Sensation de vertiges / Étourdissement.
Voir la note complète de MEDTRONIC:
20220505-mes-heartwave-medtronic
Voici la mise à jour de Juillet 2022:
La société ABBOTT, alerte sur un problème de dysfonctionnement de certains de ses défibrillateurs « GALANT » MODÈLES CDVRA500Q, CDDRA500Q, CDHFA500Q. Ce dysfonctionnement empêche la surveillance et le contrôle à distance de ces appareils.
Vous pouvez consulter la note du constructeur complète ci-dessous:
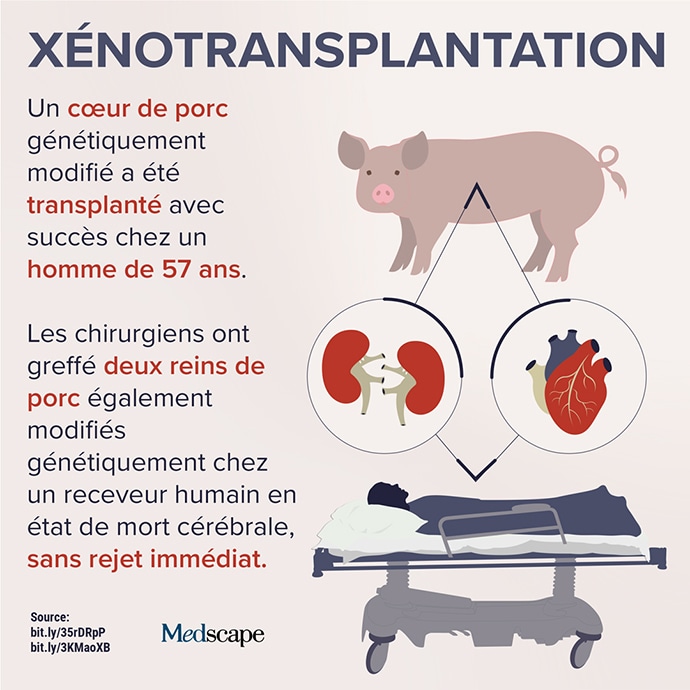
Selon un rapport de l’Observatoire mondial sur le don et la transplantation, moins de 10 % des besoins mondiaux en greffes d’organes ont été couverts en 2020. En France, plus de 24 000 patients sont sur une liste d’attente de greffes. Aux États-Unis, ils seraient 100 000. C’est pourquoi les données récentes sur la xénotransplantation ont suscité beaucoup d’intérêt cette semaine.
En octobre 2021, des chirurgiens de NYU Langone Health à New York avaient greffé un rein de porc chez un patient en état de mort cérébrale pour la première fois sans observer de rejet immédiat. Les gènes de ce porc avaient été modifiés de sorte que ses tissus ne contenaient plus une molécule connue pour déclencher un rejet quasi immédiat. Pendant 3 jours, le nouveau rein a été rattaché aux vaisseaux sanguins du receveur et maintenu à l’extérieur de son corps, permettant aux chercheurs d’y accéder. Les résultats des tests de la fonction rénale de l’organe transplanté étaient normaux, sans preuve de rejet précoce généralement observé lorsque des reins de porc non modifiés sont transplantés chez des primates non humains. Le niveau élevé de créatinine du receveur est revenu à la normale après la greffe.
En janvier, des chirurgiens du centre médical de l’Université du Maryland (UMMC), à Baltimore, ont réussi une transplantation cardiaque de porc chez un humain. Un communiqué de presse [1] explique que trois gènes associés au rejet médié par les anticorps ont été éliminés chez le porc donneur. Six gènes humains associés à l’acceptation immunitaire de l’organe ont également été insérés dans le génome de l’animal. Avant la greffe, le patient avait besoin d’une assistance circulatoire mécanique. La transplantation cardiaque standard à l’UMMC et dans d’autres établissements lui avait été refusée. Souffrant d’arythmies ventriculaires, il n’était pas non plus admissible à un dispositif d’assistance ventriculaire implanté. Le porc donneur provenait de Revivicor, Inc, une société de médecine régénérative. Un médicament antirejet expérimental a également été utilisé, en plus des immunosuppresseurs couramment utilisés.
Fin janvier, peu de temps après la transplantation cardiaque, des chirurgiens de l’Université de l’Alabama à Birmingham (UAB) ont transplanté deux reins de porc modifiés génétiquement selon le même modèle chez un receveur humain en état de mort cérébrale. Les reins transplantés ont filtré le sang, produit de l’urine et n’ont pas été immédiatement rejetés, restant viables jusqu’à la fin de l’étude 77 heures après la transplantation. Bien que l’équipe de NYU Langone Health ait été la première à annoncer la réussite d’une greffe du même type, le travail de l’UAB est la première étude sur une telle procédure évaluée par des pairs et publiée. [2,3] Les reins ont été obtenus à partir de porcs génétiquement modifiés provenant également de Revivicor ; ils avaient un total de 10 gènes modifiés, y compris l’hormone de croissance porcine. Les chercheurs de l’UAB indiquent que bien que la transplantation soit le critère de traitement standard de l’insuffisance rénale terminale, moins de 25 000 transplantations rénales sont effectuées chaque année aux États-Unis et 240 américains décèdent chaque jour sous dialyse.
Ces xénogreffes ont suscité de nombreuses réactions à travers le monde. Si la possibilité de réduire le nombre décès des personnes en attente de greffe a redonné espoir a beaucoup, d’autres attirent l’attention sur les considérations éthiques de ces avancées, telles que la sélection des patients et le coût. Certains rappellent également que la xénotransplantation n’en est qu’à ses débuts…
Voir aussi Un cœur de porc greffé sur un homme!
Jean-Pierre Usdin
25 janvier 2022
Modérateurs Pr Joachim ALEXANDRE (Pharmacologie clinique, Caen) et Dr Arnaud BISSON (Cardiologue/Oncologue, Tours)
Paris, France – Le risque hémorragique d’un patient ayant un cancer est majoré par rapport à la population générale et la survenue d’une FA l’expose aux complications thrombotiques avec un risque hémorragique plus élevé. La spécificité du patient ayant ces deux affections concomitantes tient aussi au traitement anticancéreux, parfois pourvoyeur de FA et induisant des modifications enzymatiques.
Les traitements anti-arythmiques et anticoagulants – déterminés par des scores cliniques – doivent tenir compte de cette interférence pour la prescription et la posologie.
S’il n’existe pas d’études randomisées chez ces patients avec les anticoagulants oraux directs (AOD), les métanalyses signalent une efficacité/sécurité correcte : ils peuvent – voire doivent – être utilisés les patients cancéreux souffrant d’une FA.
La collaboration du cardiologue et de l’oncologue permettra dans la plupart des cas la poursuite du traitement anti-cancéreux. Le sujet a fait l’objet d’une présentation par 4 experts lors des Journées Européennes de la Société Française de Cardiologie (JESFC 2022).
Retrouvez l’article complet ici: Cancer et FA
Dans l’attente de la mise à disposition de ce traitement dans le cadre de son AMM, une autorisation d’accès précoce a été donnée par la HAS ce 7 janvier 2022.
Communiqué HAS : Covid-19 : accès précoce accordé au Xevudy® en traitement curatif
Xevudy est indiqué pour le traitement des adultes et adolescents (âgés de 12 ans et plus et pesant au moins 40 kg) atteints de la maladie à coronavirus 2019 (Covid-19) qui ne nécessitent pas de supplémentation en oxygène et qui présentent un risque accru d’évolution vers une forme sévère de la Covid-19.
L’utilisation de cette monothérapie doit se faire dans le respect du protocole d’utilisation thérapeutique (PUT) défini par la HAS et inclure un suivi virologique.
A ce jour, Xevudy et Ronapreve s’administrent en établissement de santé, en raison de la surveillance d’au moins une heure qui doit être mise en place après administration. Evusheld est disponible en ambulatoire en prophylaxie, sur prescription hospitalière (rétrocession).
En prophylaxie pré-exposition
Ronapreve ne doit plus être utilisé. Pour les personnes ayant déjà bénéficié d’une prophylaxie pré-exposition par Ronapreve, le passage à Evusheld doit être fait le plus rapidement possible, ou au plus tard un mois suivant la dernière injection de Ronapreve, et ne doit pas dépendre d’un dosage d’anticorps anti-S. Afin de vérifier l’absence de contamination par le Sars-CoV-2, il convient d’effectuer un test RT-PCR 72 heures avant l’administration d’Evusheld.
En prophylaxie post-exposition


En complément de la campagne de vaccination notamment la campagne de rappel et du renforcement des gestes barrières, la recherche française et internationale s’est mobilisée avec une rapidité inédite. Trois traitements constitués d’anticorps monoclonaux sont d’ores et déjà pris en charge de façon dérogatoire en France : Ronapreve, Evusheld et Xevudy.
Aujourd’hui, la HAS donne son feu vert à l’utilisation du Paxlovid. Cet antiviral est indiqué pour les adultes infectés par le SARS-CoV-2 qui ne nécessitent pas une supplémentation en oxygène et qui présentent un risque élevé d’évolution de leur infection vers une forme sévère de la maladie. Cette autorisation d’accès précoce est accordée suite à l’avis de l’ANSM ayant conclu sur la base de l’évaluation des données précliniques et cliniques disponibles à un rapport bénéfice/risque présumé favorable dans l’indication thérapeutique.
La HAS rappelle que Paxlovid n’est pas destiné à être utilisé comme substitut à la vaccination contre le SARS-CoV-2. Plus largement, la mise en œuvre des traitements anti-Covid-19 ne dispense pas les patients du respect des mesures barrières et de distanciation physique.
Le Paxlovid (nirmatrelvir PF-07321332 / ritonavir) est le premier antiviral anti-SARS-CoV-2 à obtenir une autorisation d’accès précoce. Il se présente sous forme de comprimés (2 comprimés de nirmatrelvir PF-07321332 et 1 comprimé de ritonavir) à prendre par voie orale deux fois par jour pendant cinq jours. Il est recommandé de l’administrer dès que possible après le diagnostic positif à la Covid-19 et au maximum dans les cinq jours suivant l’apparition des symptômes.
Ce traitement cible l’enzyme nécessaire à la réplication virale, la protéase 3C-like, et en inhibant son action, il bloque la réplication du SARS-CoV-2 dans l’organisme.
Dans le contexte de prédominance du variant Omicron, et malgré sa moindre sévérité, la HAS considère que le besoin en traitements pour les patients fragiles atteints par la Covid-19 n’est pas satisfait. Les données disponibles pour évaluer l’efficacité de ce traitement ont démontré une réduction du risque de progression vers une forme sévère de la Covid-19 (hospitalisation ou décès) d’environ 85,2 % (étude EPIC-HR) après son administration. De plus, le mécanisme d’action du Paxlovid laisse espérer une efficacité maintenue sur les différents variants, y compris Omicron. Des données préliminaires in vitro suggèrent en effet que les variants préoccupants qui circulent actuellement sont sensibles au traitement. La HAS souligne par ailleurs que la présentation du Paxlovid sous forme de comprimés facilite son accessibilité en ville.
Compte tenu de ces éléments, la HAS autorise l’accès précoce au Paxlovid pour les populations à risque élevé de forme sévère de la maladie.
Néanmoins, la HAS relève que l’antiviral est contre-indiqué chez les personnes avec une insuffisance hépatique sévère ou une insuffisance rénale sévère. Une adaptation de la posologie est nécessaire chez les patients présentant une insuffisance rénale modérée. Par ailleurs, il n’est pas recommandé d’utiliser Paxlovid pendant la grossesse.
La HAS pointe également le risque important d’interactions médicamenteuses lors de la prise de Paxlovid pour les patients qui prennent un autre traitement. Ces interactions vont constituer :
C’est au médecin qu’il revient d’apprécier avec son patient les contre-indications médicamenteuses à l’utilisation de Paxlovid. Ces interactions nécessitent la mise en place d’un suivi rapproché.
En raison de ce risque d’interactions médicamenteuses, la HAS souhaite la rapide mise à disposition des prescripteurs d’un outil pratique d’aide à la prescription.
La HAS rappelle qu’en cas de contre-indication, le recours à l’anticorps monoclonal Xevudy est possible en curatif. En outre, le traitement prophylactique par anticorps monoclonaux Evusheld doit pouvoir être proposé aux patients éligibles.
La HAS recommande la mise en place d’une cohorte de suivi de ce traitement anti-Covid-19, qui aura pour objectif d’évaluer l’efficacité immunovirologique et clinique dans divers groupes de patients et de suivre le risque d’émergence de résistances potentielles, notamment chez les patients immunodéprimés. La HAS souhaite être destinataire de toute nouvelle donnée permettant de réévaluer l’intérêt de ce traitement. Elle souhaite par ailleurs que des essais cliniques sur ce traitement en association puissent être prochainement mis en place.
Comme pour chacune de ses évaluations, la HAS relève que l’indication du Paxlovid est susceptible d’évoluer en fonction de l’état des connaissances scientifiques et du contexte épidémiologique.
Le Paxlovid est le premier traitement de la Covid-19 qui sera accessible en ville et pourra être prescrit par les médecins généralistes. Afin de les accompagner, notamment lors de l’arrivée des premières doses qui sont en nombre limité, la HAS publie de nouvelles Réponses rapides. Elle rappelle à cette occasion la liste des personnes concernées en premier lieu par ce traitement.
Si les patients ne présentent pas de contre-indication, la HAS recommande de prescrire Paxlovid pour les patients adultes à risque de forme grave de Covid-19, c’est-à-dire :
| Les données d’activité in vitro disponibles des traitements de la Covid-19 disponibles sur le variant Omicron montrent :
Anticorps monoclonaux
Antiviraux
|
L’ANSM a été informée de la rupture d’approvisionnement imminente, dès janvier 2022, du cœur total artificiel SynCardia ( Dispositif bi-ventriculaire implantable et pulsatile, remplaçant les ventricules et les valvules natifs du patient, qui permet la circulation du sang à la fois dans le système pulmonaire et dans le système de circulation générale) en France. Celle-ci est liée à des facteurs d’ordre réglementaire et logistiques.
Selon les informations communiquées par le distributeur français, les stocks d’équipements externes en France sont suffisants pour assurer la prise en charge des patients actuellement porteurs d’un cœur artificiel SynCardia jusqu’à leur transplantation.
Le fabricant SynCardia Systems LLC travaille actuellement à trouver des solutions dans les meilleurs délais. Cependant, les informations disponibles à ce jour laissent penser que cette situation pourrait s’étendre sur toute l’année 2022 voire jusqu’en 2023.
Dans l’intervalle, l’ANSM travaille avec l’ensemble des parties prenantes pour identifier les solutions alternatives disponibles sur le marché en France et en Europe afin d’assurer la continuité des soins des patients atteints d’insuffisance cardiaque bi-ventriculaire terminale.
Voici l’annonce officielle de SynCardia: Rupture Syncardia