France — Grâce à une technologie innovante encore peu utilisée en France, les équipes du pôle de Chirurgie Cardiaque de l’Hôpital Marie Lannelongue ont pu repousser les limites de préservation d’un cœur au cours d’une transplantation. Avec deux avantages majeurs : augmenter les chances de succès en évaluant la qualité du cœur et accroître le nombre de greffons disponibles en allongeant la durée de préservation du cœur prélevé au-delà de 4 heures. Explications du Dr Julien Guihaire, chirurgien cardiaque spécialisé en transplantation à l’Hôpital Marie Lannelongue (Groupe Hospitalier Paris Saint Joseph, Université Paris Saclay, Le Plessis Robinson, 92).
Faire face à la pénurie
Principal défi à relever dans le domaine de la transplantation cardiaque : faire face à la pénurie d’organes. Aujourd’hui, « il y a en moyenne deux candidats receveurs compatibles pour un seul greffon cardiaque disponible », explique le Dr Guihaire. Pour parer à ce manque de greffons, la solution au cours de ces dernières années a été de repousser les limites de sélection des greffons, lesquels proviennent de donneurs de plus en plus âgés. « L’âge moyen d’un donneur est de 50 ans passé, parfois même on va jusqu’à 65 ans, une procédure qui n’aurait jamais été envisagée il y a une quarantaine d’années, commente le chirurgien. Le corollaire de cette extension de sélection, c’est de prélever des cœurs de potentiellement moins bonne qualité, chez des patients avec des comorbidités (tabac, hypertension…). De fait, on s’expose à de moins bons résultats de la transplantation. En France, le risque de défaillance cardiaque immédiate dans les suites de la transplantation, c’est-à-dire, d’avoir un cœur qui ne repart pas correctement est de l’ordre de 40% ».
Conserver le cœur à greffer bien au-delà de 4 heures
Il est donc urgent de réfléchir à des solutions pour optimiser la qualité des organes et l’une d’elle est ce dispositif très innovant que viennent d’acquérir les équipes du pôle de Chirurgie Cardiaque de l’Hôpital Marie Lannelongue. « Cette machine dans laquelle on place le cœur permet de le faire rebattre et de le conserver plus longtemps que la méthode conventionnelle de préservation au froid dans une glacière », décrit le médecin transplanteur. Concrètement, il s’agit d’une machine transportable dans laquelle on va placer le cœur et le perfuser avec du sang oxygéné (voir schéma ci-dessous et vidéo). Cela va permettre au cœur de battre, de reprendre une activité et ainsi de réduire la durée d’ischémie qui est critique en transplantation. Placé sur cette machine, le cœur peut ainsi être préservé pendant plusieurs heures.
Alors qu’aujourd’hui lorsque le cœur d’un donneur est prélevé, le greffon n’est plus perfusé et l’ischémie engendrée va détériorer l’organe. Pour prévenir les lésions, le cœur est arrêté, refroidi et conservé dans un liquide à 4°C pour son transport. Plus la durée d’ischémie du greffon est courte, plus grandes sont les chances de réussite de la greffe. « Commence alors une véritable course contre la montre, avec un délai de moins de 4 heures à respecter pour faire repartir le greffon cardiaque sur le patient receveur, qui de fait peut limiter l’utilisation de certains organes notamment lorsque la durée de transport est supérieure à 3 heures.
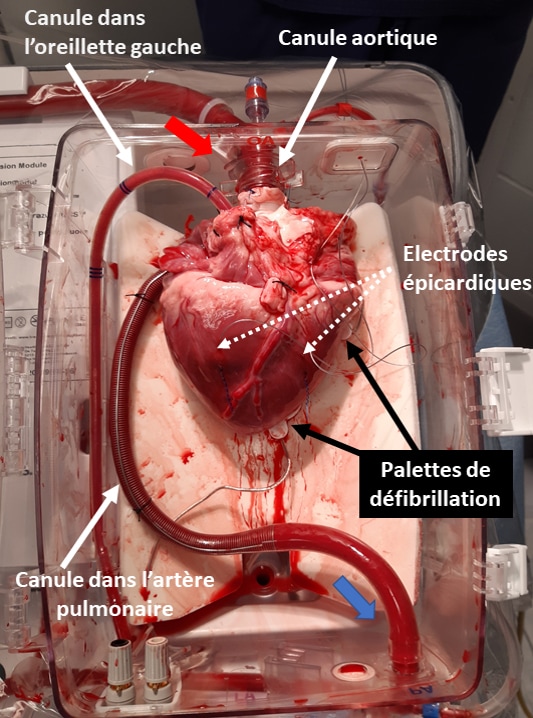 Intrumentation du greffon cardiaque sur un module de perfusion ex vivo (Organ Care System, TransMedics, USA).
Intrumentation du greffon cardiaque sur un module de perfusion ex vivo (Organ Care System, TransMedics, USA).
Les flèches rouges et bleues représentent le sens du flux sanguin, respectivement depuis la ligne artérielle d’injection jusqu’à la ligne veineuse de drainage. La perfusion coronaire est assurée par la canulation aortique et le drainage veineux coronaire est effectué par la canule placée dans l’artère pulmonaire, les deux veines caves étant ligaturée pendant la durée de perfusion sur machine. Une canule de drainage supplémentaire est placée dans le ventricule gauche via l’oreillette gauche pour éviter toute embolie gazeuse coronaire. Des électrodes épicardiques sont placées sur la face inférieure du cœur pour permettre un électro-entraînement par pace maker externe à la fréquence recommandée de 80 battements par minute. Deux palettes de défibrillation externe sont placées sous le cœur et reliées à un défibrillateur externe.
Prolonger la durée de préservation du cœur – jusqu’à 6, 8, 10 heures –, c’est donc augmenter la capacité de transplanter des organes jusqu’alors inexploitables, du fait de leur éloignement géographique. « Tout dernièrement, cette machine nous a permis d’aller prélever un cœur auprès d’un donneur qui se trouvait en théorie dans un hôpital géographiquement inaccessible pour nos équipes », explique le Dr Guihaire. « Les CHU les plus proches n’avaient pas de receveur compatible. Sans la machine qui a permis de préserver l’organe pendant plus de 7 heures, le cœur aurait été perdu, alors qu’aujourd’hui le malade greffé va très bien », ajoute-t-il.
L’autre grand avantage de la machine, outre l’allongement de la durée de préservation du cœur, « c’est que l’on peut évaluer en temps réel la qualité de l’organe grâce au suivi de paramètres biologiques prélevé sur le circuit de perfusion du cœur, ajoute le chirurgien. A ce jour, une échographie n’apporte pas d’informations intéressantes car le cœur bat mais ne « travaille » pas. « Nous évaluons d’ailleurs au sein de notre laboratoire de recherche des outils pour mieux explorer les cœurs quand ils sont sur machine » confie-t-il.
Un coût encore prohibitif et pas de remboursement
Ce dispositif n’est toutefois pas sans contraintes : « beaucoup de compétences médicales et de ressources humaines sont nécessaires pour réanimer un organe isolé [avant le transport] », résume le chirurgien. Autre grand frein à l’utilisation à large échelle de ce dispositif performant (qui s’est vu attribué en avril 2021 l’équivalent d’un marquage CE par la FDA) : son coût et l’absence de remboursement par l’assurance maladie. Si l’on excepte l’équipement hardware de ce système, le module de perfusion de l’organe est à usage unique pour des raisons évidentes d’asepsie et il faut compter 45 000 euros par greffe, sachant qu’un hôpital dispose d’une enveloppe budgétaire d’environ 70 000 euros pour couvrir tous les frais inhérents à une transplantation. Pour se doter de cette technologie, le Dr Guihaire a fait appel à un fonds de dotation pour pouvoir couvrir les premiers frais, mais ce système de financement ne lui garantit pas une « utilisation pérenne », souligne-t-il. Ce coût élevé explique pour partie que cette machine, fabriquée par une compagnie américaine (TransMedics) et qui est sur le marché depuis une dizaine d’années aux Etats-Unis et en Australie – avec plus de 800 transplantations à son actif –, ne soit pas jusqu’à présent très répandue en Europe. D’ailleurs, en France, seules trois équipes en disposent. Pourtant, devant les bénéfices incontestés du dispositif, le Dr Guihaire espère qu’un mode de financement pérenne puisse être trouvé. Et ce d’autant, qu’il souhaite pouvoir en étendre les potentialités.
S’intéresser à une autre catégorie de donneurs
Car la raison fondamentale de l’intérêt qu’il porte à ce dispositif, reconnait le chirurgien, c’est de pouvoir s’adresser, à moyen terme, à une autre catégorie de donneurs, à savoir les personnes décédées d’arrêt cardiaque contrôlé. « Ce sont ces patients pour lesquels une limitation des thérapeutiques a été décidée et acceptée par les proches car ils sont dans un état irréversible et ne se réveilleront jamais. Leur cerveau est endommagé, mais ils ne sont pas pour autant en état de mort cérébral, comme c’est le cas par exemple après certains traumatismes crâniens graves. A ce jour, la loi française autorise à arrêter les soins et, depuis moins de 10 ans, à prélever les organes comme le foie, les reins et poumons mais pas le cœur qui peut être endommagé, explique le chirurgien. D’où l’intérêt d’une machine permettant de préserver le cœur mais surtout d’évaluer sa viabilité après la survenue de l’arrêt cardiaque. « C’est ce que les Anglais et les Australiens, qui ont accès à ce type de donneurs, font depuis 2014 avec d’excellents résultats à 5 ans, comparables à ceux de la transplantation conventionnelle à partir de donneurs en état de mort encéphalique ». Dans cette perspective, le dispositif se révélerait, non seulement utile mais indispensable. « C’est aujourd’hui mon cheval de bataille », conclut le Dr Guilhaire.
