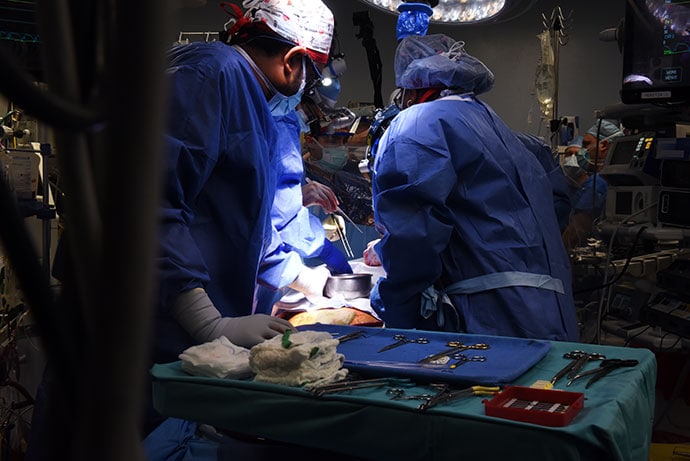
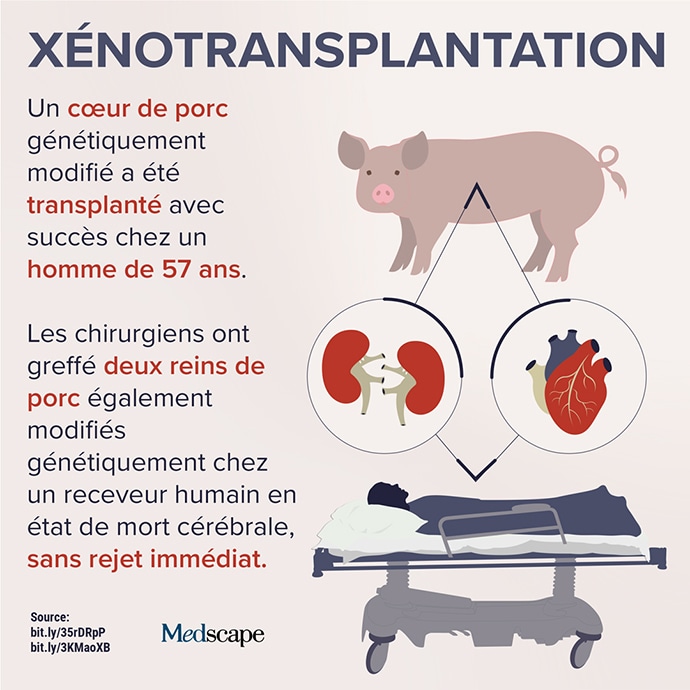
Baltimore, Etats-Unis – Et de deux. Trois mois et demi après la première xénotransplantation d’un rein de porc chez une patiente en état de mort cérébrale, l’école de médecine de l’université du Maryland (Baltimore, Etats-Unis) a annoncé lundi 10 janvier qu’un cœur de cochon génétiquement modifié avait été transplanté avec succès chez un homme de 57 ans.
Trois jours après l’intervention, il se portait bien.« Cette transplantation d’organe démontre pour la première fois qu’un cœur issu d’un animal génétiquement modifié peut fonctionner comme un cœur humain sans rejet immédiat par l’organisme receveur », se sont enthousiasmés les chirurgiens américains qui ont réalisé la prouesse.
Atteint d’une insuffisance cardiaque au stade terminal et d’une arythmie, David Bennett, qui a reçu le cœur porcin, avait été déclaré inéligible à la transplantation classique. Interrogé par Medscape édition française, le Pr Philippe Ménasché (chirurgien cardiaque, HEGP, Paris), pionnier de la thérapie cellulaire, a déclaré : « Je suis admiratif de ce succès car je me rends compte qu’il s’agit de l’aboutissement d’années et d’années de travail ». Si la prouesse a été saluée partout dans le monde, le recul n’est que de 72 heures après l’intervention, puisqu’il n’y a pas eu de communication depuis le 10 janvier.
Un cœur d’un cochon génétiquement modifié
Le cœur utilisé est issu d’un cochon génétiquement modifié dans un double objectif : empêcher le rejet hyperaigu et éviter la contamination du receveur par un virus endogène du porc. Grâce à l’éditing des gènes, le greffon est notamment dépourvu de sucre alpha-gal à la surface de ses cellules, ce qui permet de résoudre ce problème d’incompatibilité et de rejet aigu. D’autre part, six gènes humains associés à la tolérance immunitaire ont été introduits dans le génome porcin. De plus, une autre modification génétique par la technique des ciseaux moléculaires CRISPR-Cas9 a permis de se débarrasser du matériel génétique du virus endogène porcin (PERV).
Il faut savoir que l’ADN viral, incorporé au sein même du génome du porc, se transmet au fil des générations de porcs. « Enfin, un gène porcin a été inactivé afin d’éviter que le cœur du cochon ne grossisse trop. Dix gènes ont été en tout modifiés dans le cochon donneur », indique le communiqué. La biotech, Revivicor, d’où provient le cœur est la même qui avait fourni le rein modifié il y a quelques mois.
En attendant la transplantation classique
Si la FDA a autorisé cette procédure expérimentale à titre compassionnel pour David Bennett, quel est l’avenir de la xénogreffe cardiaque ? « Selon moi, la xénogreffe cardiaque serait idéalement indiquée pour les patients ayant besoin d’une suppléance cardiaque en attendant une transplantation cardiaque classique », considère le Pr Ménasché qui détaille « Pour certains patients, elle pourrait remplacer le dispositif d’assistance, beaucoup plus lourd en termes de complications thromboemboliques et infectieuses ».
Il n’est pas favorable au fait que les patients récusés pour la transplantation classique puissent avoir accès à une xénogreffe. « Je trouve que c’est surprenant de pouvoir envisager une transplantation « low-cost » » argumente-t-il préférant imaginer la xénogreffe comme une solution d’attente quand les patients sont sur liste d’attente pour une transplantation classique. Le recul n’est pas encore suffisant pour préconiser de se passer de la transplantation cardiaque, une procédure de routine validée, au profit d’une procédure toute récente et non validée.
Que devient la thérapie cellulaire ? Piste prometteuse dans l’insuffisance cardiaque, la thérapie cellulaire continue de faire l’objet d’essais cliniques, a indiqué Philippe Ménasché. Les quelques milliers de patients ayant déjà eu accès à cette procédure ont vu pour la plupart une amélioration de leur fonction cardiaque. Pour certaines cela a permis de retarder le moment de la transplantation.
D’autres approches, plus récentes, enthousiasment le chirurgien chercheur, comme le fait d’utiliser des CAR T cells qui expriment des anticorps contre la fibrose ou bien une approche régénérative fondée sur la prolifération des cellules restantes après un infarctus du myocarde. A suivre.
Mise à jour du 22/03/2022
Baltimore, Etats-Unis – David Bennett, le premier patient de l’histoire à avoir reçu un cœur de porc génétiquement modifié, est décédé le 8 mars.
Il avait reçu la greffe le 7 janvier et a vécu pendant deux mois après la chirurgie.

David Bennett
« Son état a commencé à se détériorer il y a quelques jours. Et lorsqu’il est devenu évident qu’il ne s’en remettrait pas, il a reçu des soins palliatifs. Il a pu communiquer avec sa famille pendant ses dernières heures », indique le communiqué de l’Université du Maryland où l’intervention a eu lieu.
« Nous sommes dévastés par la perte de Mr Bennett. Il s’est avéré être un patient courageux qui s’est battu jusqu’au bout. Nous adressons nos plus sincères condoléances à sa famille », a déclaré le Dr Bartley P. Griffith (UMMC) qui a réalisé la transplantation de cœur de porc chez le patient.
David Bennett s’était rendu pour la première fois à l’UMMC en octobre 2021, où il avait été mis sous oxygénation par membrane extracorporelle (ECMO). Atteint d’une insuffisance cardiaque au stade terminal et d’une arythmie, David Bennett avait été déclaré inéligible à la transplantation classique. Le 31 décembre, la Food and Drug Administration américaine avait accordé une autorisation d’urgence compassionnelle pour la xénogreffe.
« Après la chirurgie, le cœur transplanté a très bien fonctionné pendant plusieurs semaines sans aucun signe de rejet », indique l’Université du Maryland.
« Comme pour toute première intervention chirurgicale de transplantation au monde, celle-ci a fourni des informations précieuses qui, espérons-le, aideront les chirurgiens transplanteurs à améliorer les résultats afin d’offrir potentiellement un gain de vie aux futurs patients », a commenté le Dr Griffith.
« Nous restons optimistes et prévoyons de poursuivre nos travaux dans de futurs essais cliniques », a ajouté le Dr Muhammad M. Mohiuddin (Professeur de Chirurgie et Directeur Scientifique du Programme de Xénotransplantation Cardiaque à l’UMSOM).
Interrogé après la transplantation en janvier par Medscape édition française, le Pr Philippe Ménasché (chirurgien cardiaque, HEGP, Paris), pionnier de la thérapie cellulaire s’était montré « admiratif de ce succès […] l’aboutissement d’années et d’années de travail », tout en indiquant que selon lui, la xénogreffe cardiaque serait idéalement indiquée pour les patients ayant besoin d’une suppléance cardiaque en attendant une transplantation cardiaque classique. « Pour certains patients, elle pourrait remplacer le dispositif d’assistance, beaucoup plus lourd en termes de complications thromboemboliques et infectieuses ».
Un cœur d’un cochon génétiquement modifié
Le cœur utilisé qui a été utilisé est issu d’un cochon génétiquement modifié dans un double objectif : empêcher le rejet hyperaigu et éviter la contamination du receveur par un virus endogène du porc. Grâce à l’éditing des gènes, le greffon est notamment dépourvu de sucre alpha-gal à la surface de ses cellules, ce qui permet de résoudre ce problème d’incompatibilité et de rejet aigu. D’autre part, six gènes humains associés à la tolérance immunitaire ont été introduits dans le génome porcin. De plus, une autre modification génétique par la technique des ciseaux moléculaires CRISPR-Cas9 a permis de se débarrasser du matériel génétique du virus endogène porcin (PERV).
Il faut savoir que l’ADN viral, incorporé au sein même du génome du porc, se transmet au fil des générations de porcs. « Enfin, un gène porcin a été inactivé afin d’éviter que le cœur du cochon ne grossisse trop. Dix gènes ont été en tout modifiés dans le cochon donneur », indique le communiqué. La biotech, Revivicor, d’où provient le cœur est la même qui avait fourni le rein modifié il y a quelques mois.
Mise à jour du 14-05-22
Xénogreffe de cœur de porc : le virus porcin suspecté dans la mort du patient américain
Baltimore, Etats-Unis – David Bennett, le premier patient de l’histoire à avoir reçu un cœur de porc génétiquement modifié, est décédé le 8 mars sans que l’origine de sa mort ne soit communiquée.
Il avait reçu la greffe le 7 janvier et a vécu pendant deux mois après la chirurgie.
Un rapport publié le 4 mai dans MIT Technology Review semble apporter une explication à son décès
Un cytomégalovirus porcin (CMVP) présent dans le cœur n’avait pas été détecté avant l’opération et pourrait (ou non avoir) contribué à la mort, selon l’article.
« La question fait maintenant l’objet de grandes discussions parmi les spécialistes, qui pensent que l’infection a potentiellement contribué à la mort de David Bennett et constitue une raison plausible expliquant que le cœur n’ait pas fonctionné plus longtemps », indique le journaliste Antonio Regalado.
C’est le chirurgien qui a pratiqué l’opération, Bartley P. Griffith (University of Maryland School of Medicine, Baltimore), qui a annoncé la découverte du CMVP lors d’une présentation en ligne de la Société américaine de transplantation le 20 avril dernier.
Suite à la greffe, l’évolution clinique initialement prometteuse du patient s’est compliquée d’épisodes répétés d’infections et d’ajustements de son traitement immunosuppresseur. Selon les experts, ces épisodes pourraient avoir contribué à sa mort, dont la cause réelle reste indéterminée ou du moins non-encore-confirmée.
« Nous commençons à comprendre pourquoi il est décédé », indique le Dr Griffith dans l’article, reconnaissant que le virus porcin « était peut-être l’agent » déclencheur des événements qui ont conduit à la mort de David Bennett.
Nous commençons à comprendre pourquoi il est décédé. Bartley P. Griffith
Les spécialistes de la xénotransplantation savent que le CMVP causer problème dans l’utilisation des organes de porc et recherchent sa présence avant de tenter une greffe sur des modèles animaux, précise l’article qui fait référence à une série de greffes de cœur de porc pratiquée sur des babouins en Allemagne. Les cœurs « n’ont fonctionné que quelques semaines lorsque le virus était présent, tandis que les organes exempts d’infection pouvaient fonctionner plus de six mois ».
Le cœur que David Bennett a reçu avait fait l’objet d’un dépistage bactériologique et virologique approfondi mais les recherches ont apparemment échoué. Dans l’article du MIT Technology Review, le premier auteur de la série allemande sur les babouins avance une explication.
« L’équipe américaine semble avoir recherché le virus au niveau du museau du porc, mais il se cache souvent plus profondément dans les tissus », explique le Pr Joachim Denner (Institut de virologie, Université libre de Berlin) qui soutient que « le virus peut être détecté et facilement éliminé des populations de porcs, mais malheureusement, ils n’ont pas utilisé un bon test et n’ont pas détecté le virus ».
Que le CMVP ait échappé à la détection avant l’opération « apporte de nouveaux arguments aux personnes qui se demandent si l’expérience aurait réellement dû avoir lieu », souligne l’article du MIT Technology Review. « C’est un signal d’alerte », commente le Pr Arthur Caplan, bioéthicien (Université de New York, New York) dans le journal ajoutant : « Si les médecins ne peuvent pas prévenir ou contrôler l’infection, alors de telles expériences sont difficiles à justifier ».
Voir aussi: Dans l’Actu : les xénogreffes




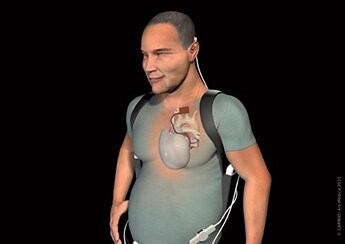 Le cœur artificiel total de CARMAT est composé d’une bioprothèse implantable et d’un système portable d’alimentation externe auquel elle est reliée en permanence. Il a été inventé par le Pr Alain Carpentier pour pallier le manque de greffons pour les personnes souffrant d’insuffisance cardiaque terminale irréversible. La première implantation chez l’homme a été réalisée en 2013 à l’hôpital européen Georges-Pompidou. En 2016, la startup française a cependant dû stopper son essai clinique après la mort d’un cinquième patient. Aussi, en 2018, la société a suspendu son essai en Europe en raison des risques de dysfonctionnement des prothèses. Après des modifications, le cœur artificiel a obtenu le « marquage CE » pour l’indication d’attente de transplantation, fin décembre 2020. En parallèle, l’ANSM a autorisé Carmat à reprendre les implantations en France en octobre dernier. Une nouvelle étude clinique chez 52 patients greffés a débuté.
Le cœur artificiel total de CARMAT est composé d’une bioprothèse implantable et d’un système portable d’alimentation externe auquel elle est reliée en permanence. Il a été inventé par le Pr Alain Carpentier pour pallier le manque de greffons pour les personnes souffrant d’insuffisance cardiaque terminale irréversible. La première implantation chez l’homme a été réalisée en 2013 à l’hôpital européen Georges-Pompidou. En 2016, la startup française a cependant dû stopper son essai clinique après la mort d’un cinquième patient. Aussi, en 2018, la société a suspendu son essai en Europe en raison des risques de dysfonctionnement des prothèses. Après des modifications, le cœur artificiel a obtenu le « marquage CE » pour l’indication d’attente de transplantation, fin décembre 2020. En parallèle, l’ANSM a autorisé Carmat à reprendre les implantations en France en octobre dernier. Une nouvelle étude clinique chez 52 patients greffés a débuté.